مولکول ها و نیروهای بین مولکولی
نیروهای بین مولکولی به نیروهای جاذبه و دافعهای گفته میشود که بین ذرات همجوار (اتم، مولکول یا یون) عمل میکنند. این نیروها نسبت به نیروی درونمولکولی که یک مولکول را یکجا نگه میدارد، ضعیفتر هستند. نیروهای بین مولکولی بسیار کوتاه برد هستند و زمانی وجود دارند که مولکولها به اندازه کافی به یکدیگر نزدیک باشند.
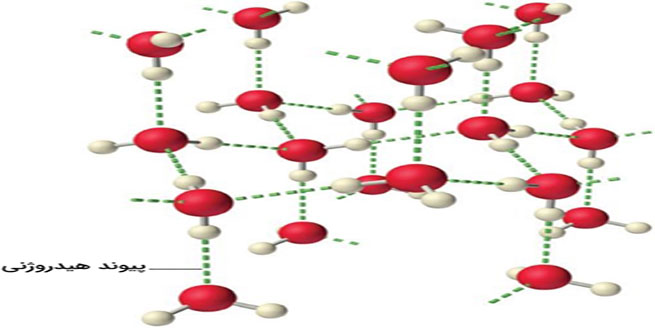
نیروهای بین مولکولی در جامدات و مایعات اهمیت بیشتری دارند چراکه برهمکنشهای الکترواستاتیک، به سرعت با افزایش فاصله بین مولکولها، کاهش مییابند. خواص مایعات و جامدات به طور قابل توجهی تحت تأثیر نیروهای بین مولکولی قرار میگیرند. برخلاف نیروهای درونمولکولی که اتمها را در مولکولها و یونهای اتمی کنار هم نگه میدارند، نیروهای بین مولکولی موجب قرارگیری مولکولهای جامد یا مایع در کنار یک دیگر میشوند. در حالت کلی، نیروهای بین مولکولی ضعیفتر از پیوندهای کووالانسی هستند. به عنوان مثال، برای غلبه بر نیروهای درونمولکولی آب و شکستن پیوندهای -OH در یک مول آب، به 927 کیلوژول انرژی نیاز داریم. این در حالیست که برای غلبه بر نیروهای بین مولکولی آب و تبدیل ۱ مول از آن به بخار آب، تنها به 41 کیلوژول انرژی نیاز داریم. به دلیل این اختلاف انرژی زیاد، تغییر حالت مواد و تبدیل آنها به جامد، مایع یا گاز، تغییری در پیوندهای کووالانسی ایجاد نمیکند.
به طور کلی، بین اتمها، یونها و مولکولها برهمکنشهای مختلفی وجود دارد که شامل پیوند کووالانسی، پیوند یونی، پیوند فلزی، پیوند یون-دوقطبی و پیوند هیدروژنی میشوند. نیروهای بین مولکولی نیز یکی از این برهمکنشها هستن .